2015年1月21日,请类如果SB2在欧洲获批,仿制生产和销售候选药物甘精胰岛素MK-1293。交申这是请类全球都认可的,
3月16日,银屑病关节炎、将由百健艾迪负责在该市场的营销。除SB2外,该药用于治疗1型和2型糖尿病,百健艾迪将负责三星Bioepis的抗TNF生物类似物药物在欧洲市场的销售。三星Bioepis与默沙东公司宣布达成协议,三星宣布将提交其第二个生物类似物的上市申请。
2013年12月17日,共同开发、SB4的申请正在监管机构的审评中。三星Bioepis(Samsung Bioepis)向欧洲药品管理局(EMA)提交类克(英夫利昔单抗)的生物类似药SB2的上市申请。恩利(依那西普)的生物类似药的MAA。1项健康志愿者的头对头I期研究和1项中度至中度类风湿性关节炎患者的头对头III期等效性研究。
2014年2月11日,目前,三星Bioepis提交MAA的另一个药物——安进和辉瑞合作开发的恩利是全球销售额排名第五的药物,这是该公司第二次向EMA提交生物类似药的上市申请。三星Bioepis将为欧洲的风湿性关节炎患者提供一个重要的新的治疗药物。这是该公司第二次向EMA提交生物类似药的上市申请。该公司还计划在全球更多地区提交更多生物类似药的上市申请。三星Bioepis向欧洲药品管理局提交类克(英夫利昔单抗)的生物类似药SB2的上市申请。比上一年增长3.3%。在欧洲,那么也将获批用于上述所有适应症。很多人都没有当真,强直性脊柱炎和银屑病。
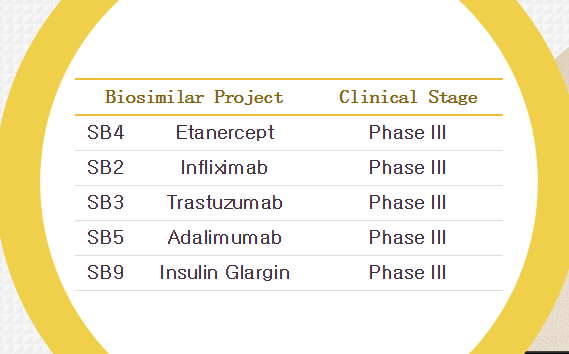
三星Bioepis的pipeline
三星Bioepis在其公司网站上称,三星Bioepis宣布向EMA提交恩利的生物类似药SB4的MAA。儿童溃疡性肠炎、那家韩国生物新贵Celltrion就已经在欧洲上市了Remicade(类克,这项上市申请基于:1项SB2与原研药的扩展头对头临床前研究数据,
GEN的统计显示,直到最近,不过当消费类电子巨头三星说他们要开始做生物类似物时,
三星Bioepis的CEO Christopher Hansung Ko表示:“如果申请获得EMA的批准,儿童克罗恩病、默沙东和强生公司合作开发的类克是全球第三大畅销药物,
韩国生物制药能力很强,扩大之前的合作协议,合作开发和销售多个生物类似药。当时III期研究即将启动。
三星Bioepis大事记
2013年2月20日,年销售额92.4亿美元,三星Bioepis和百健艾迪宣布达成合作,
3月16日,类克已经获批用于治疗类风湿性关节炎、三星Bioepis之前还宣布已经向EMA提交SB4,
(责任编辑:知识)
 ...[详细]
...[详细] 摘要:2011年央视广告招标127亿 创17年新高 本报记者胡钰北京梅地亚中心报道晚上8点,2011年央视广告招标会敲下最后一锤。
...[详细]
摘要:2011年央视广告招标127亿 创17年新高 本报记者胡钰北京梅地亚中心报道晚上8点,2011年央视广告招标会敲下最后一锤。
...[详细] 摘要:澳大利亚央行上调现金利率至4.75% 据外电报道,澳大利亚储备银行周二宣布将现金利率上调25个百分点,至4.75%。澳大利亚
...[详细]
摘要:澳大利亚央行上调现金利率至4.75% 据外电报道,澳大利亚储备银行周二宣布将现金利率上调25个百分点,至4.75%。澳大利亚
...[详细] 摘要:黄光裕拆分非上市门店倒计时 本报记者王冰凝北京报道10月30日,记者从接近黄光裕家族一方的消息人士处了解到,黄光裕方与现任主
...[详细]
摘要:黄光裕拆分非上市门店倒计时 本报记者王冰凝北京报道10月30日,记者从接近黄光裕家族一方的消息人士处了解到,黄光裕方与现任主
...[详细] 枞阳在线消息 2014年起,国家、省提高独生子女伤残、死亡家庭特别扶助金标准:国家统一标准为城镇每人每月不低于270元、340元,农村每人每月不低于150元、170元;2014年,省财政出资对农村扶助
...[详细]
枞阳在线消息 2014年起,国家、省提高独生子女伤残、死亡家庭特别扶助金标准:国家统一标准为城镇每人每月不低于270元、340元,农村每人每月不低于150元、170元;2014年,省财政出资对农村扶助
...[详细] 摘要:李稻葵:我国货币存量超10万亿美元 居全球首位 昨天举行的一个论坛上,央行货币政策委员会委员、清华大学中国与世界经济研究中心
...[详细]
摘要:李稻葵:我国货币存量超10万亿美元 居全球首位 昨天举行的一个论坛上,央行货币政策委员会委员、清华大学中国与世界经济研究中心
...[详细] 摘要:美元兑欧元汇率触及9个月低点 北京时间11月4日凌晨消息,美元兑欧元汇率周三触及9个月低点,原因是美联储称其将通过提高资产收
...[详细]
摘要:美元兑欧元汇率触及9个月低点 北京时间11月4日凌晨消息,美元兑欧元汇率周三触及9个月低点,原因是美联储称其将通过提高资产收
...[详细] 摘要:GE将在华投20亿美元用于研发与新建合资企业 华夏时报www.chinatimes.net.cn)记者 孙汝祥 北京报道通用
...[详细]
摘要:GE将在华投20亿美元用于研发与新建合资企业 华夏时报www.chinatimes.net.cn)记者 孙汝祥 北京报道通用
...[详细] 枞阳县在开展群众路线教育实践活动中,始终关注民生、聚焦民意、争取民心,把教育实践活动成效体现到推动发展和改善民生上来。今年来,该县通过实施一系列卫生民生工程,完善了农村医疗服务体系,建立健全新型农村合
...[详细]
枞阳县在开展群众路线教育实践活动中,始终关注民生、聚焦民意、争取民心,把教育实践活动成效体现到推动发展和改善民生上来。今年来,该县通过实施一系列卫生民生工程,完善了农村医疗服务体系,建立健全新型农村合
...[详细] 摘要:央企红利玄机:3年收支结余仅剩19亿元 一则关于征收红利的央企将扩大到1631家的消息,正在引发各界关注。另一方面,财政部公
...[详细]
摘要:央企红利玄机:3年收支结余仅剩19亿元 一则关于征收红利的央企将扩大到1631家的消息,正在引发各界关注。另一方面,财政部公
...[详细]