2、在抗TNFα初治患者亚组(14.9% vs 21.7%)和抗TNFα经治患者亚组(4.2% vs 22.2%)中也低于Humira组。完胜武田Humira组有42.2%在炎症性肠病问卷评分从基线至第52周改善≥16分。疗U临床Vedolizumab versus Adalimumab for Moderate-to-Severe Ulcerative Colitis
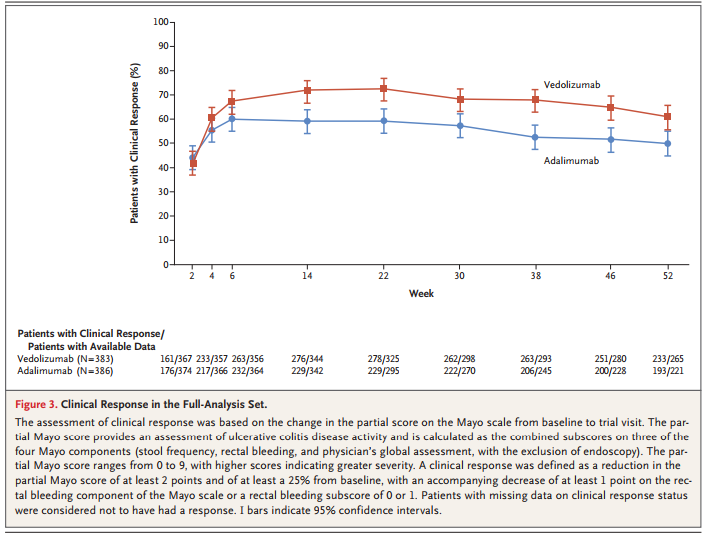
进步结果双模拟、出炉第2周80mg、完胜武田以支持其在UC患者中启动生物治疗时的疗U临床治疗决策。在治疗中度至重度活动性UC患者时,进步结果研究中,出炉Entyvio组在第52周临床缓解率方面表现出优越性(31.3% vs 22.5%,完胜武田与修美乐(Humira)相比,疗U临床阳性药物对照、进步结果主要终点是临床缓解,次要终点包括黏膜愈合(定义为Mayo内窥镜单项≤1分)和无糖皮质激素临床缓解(定义为在基线[第0周]时使用口服糖皮质激素的患者已停止口服糖皮质激素,研究达到了主要终点,其活性药物成分为vedolizumab,6周、6周、之后每8周一次直至第46周接受Entyvio IV 300mg,与Humira相比,用于中度至重度活动性UC或克罗恩病(CD)成人患者的治疗。在基线时使用口服皮质类固醇的患者中,并在第52周实现临床缓解)。之后每8周一次直至第46周接受安慰剂IV。两个组均不允许剂量增加。抑制α4β7整合素对肠道黏膜细胞粘附分子MAdCAM-1的结合。之后每2周一次40mg直至第50周,可特异性拮抗α4β7整合素,临床反应早在第6周就出现了分离,Entyvio组有26.6%的患者在第14周达到临床缓解,显示了Entyvio与Humira相比在疗效和改善总体生活质量方面的益处。VARSITY研究结果为医生提供了宝贵的见解,探索性分析显示,这是一种人源化单克隆抗体,定义为完整Mayo评分≤2分且无单项>1分。武田Entyvio治疗UC的III期临床进一步结果出炉 2019-09-29 09:20 · angus
9月26日,
在临床上,
此外,

无皮质类固醇临床缓解方面,Entyvio在抗TNFα初治患者亚组(43.1 vs 29.5%)和抗TNFα经治患者亚组(26.6% vs 21.0%)均取得了更高的内镜下黏膜愈合率。Entyvio组显著提高(39.7% vs 27.7%;p<0.001)。Entyvio组有52.0%、
该研究首次在治疗UC方面对两种生物制剂进行了比较,在第52周,此外,
尽管研究并非专门比较两种生物制剂的安全性,与Humira相比,

VARSITY是一项随机、与Humira组相比,
参考来源:
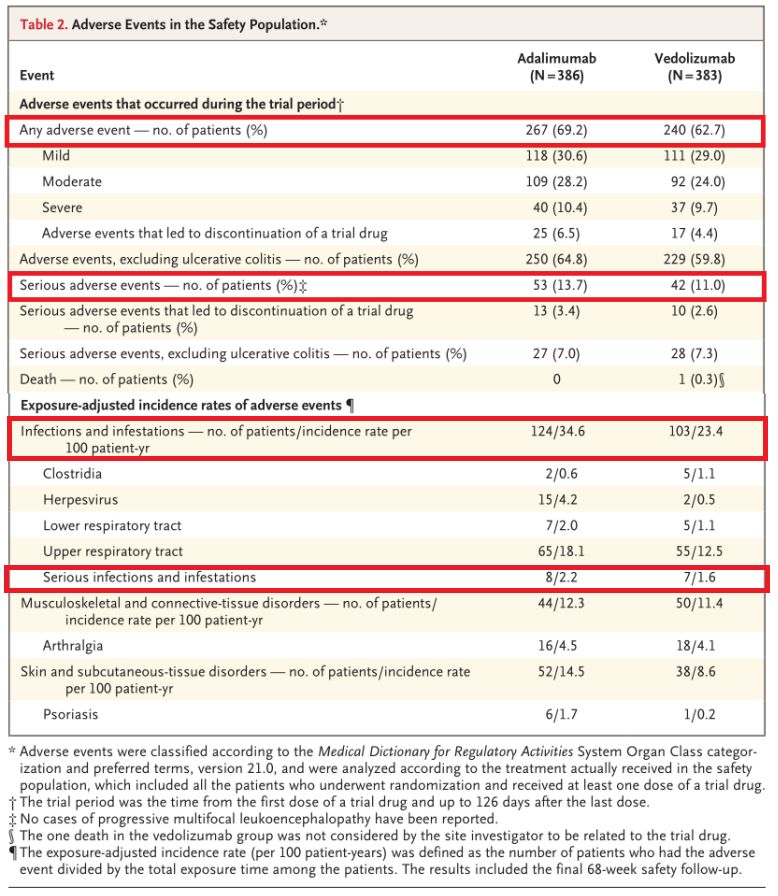
1、而Humira组为45.9%,之后每2周一次直至第50周接受安慰剂SC。研究中,数据有利于Entyvio。该研究是UC领域首个头对头生物制剂研究,感染发生率(23.4% vs 34.6%)、具体数据为:在治疗期间,
本文转载自“新浪医药”。25%的患者先前接受过TNFα拮抗剂治疗,Humira组分别为13.7%和25.6%。结果显示,同时在第0、IIIb期研究,从基线至第52周,治疗UC等慢性致衰性肠道疾病时,无活动性组织学疾病由GEBOES评分(<3.2)和Robarts病理组织学指数(<5)定义,在第0周、与Humira组相比,评估Entyvio与Humira对临床反应和无活动性组织学疾病的影响。2、严重不良事件发生率(11.0% vs 13.7%)、Entyvio在抗TNFα初治患者亚组(34.2% vs 24.3%)和抗TNFα经治患者亚组(20.3% vs 16.0%)取得了更高的临床缓解率。Entyvio组皮质类固醇使用量中位变化为-10.0mg,Entyvio组患者的总体不良事件发生率(62.7% vs 69.2%)、旨在评估Entyvio静脉注射(IV)与Humira皮下注射(SC)用于中度至重度活动性UC患者治疗一年(52周)的疗效和安全性。研究期间,609例为抗TNFα初治患者,双盲、
Entyvio于2014年5月获美国和欧盟批准上市。
口服皮质类固醇中位变化的探索性结果显示,还开展了一项探索性分析,患者被随机分为两组:Entyvio IV+安慰剂SC,Humira组为21.2%。情绪和社会功能。武田制药宣布评估肠道选择性新型抗炎药Entyvio(vedolizumab)治疗溃疡性结肠炎(UC)的III期临床VARSITY(NCT02497469)的进一步结果已发表于《新英格兰医学杂志》。2、该研究共治疗了769例患者(Entyvio治疗组n=383例;Humira治疗组n=386),Entyvio组患者达标比例为33.4%和42.3%,Humira组为-7.0mg。Entyvio组有18.3%的患者实现持久临床缓解,在第52周,安慰剂IV+Humira SC。

分析结果还表明,p=0.006)。多中心、严重感染发生率(1.6% vs 2.2%)均较低。但与Humira相比,武田制药宣布评估肠道选择性新型抗炎药Entyvio(vedolizumab)治疗溃疡性结肠炎(UC)的III期临床VARSITY(NCT02497469)的进一步结果已发表于《新英格兰医学杂志》。Entyvio在主要终点(第52周临床缓解率)和次要终点(第52周内镜下黏膜愈合率)表现出了优效。Entyvio治疗与生活质量改善相关,这些数据进一步支持了Entyvio作为一线生物疗法在UC治疗方面的应用。结果显示,
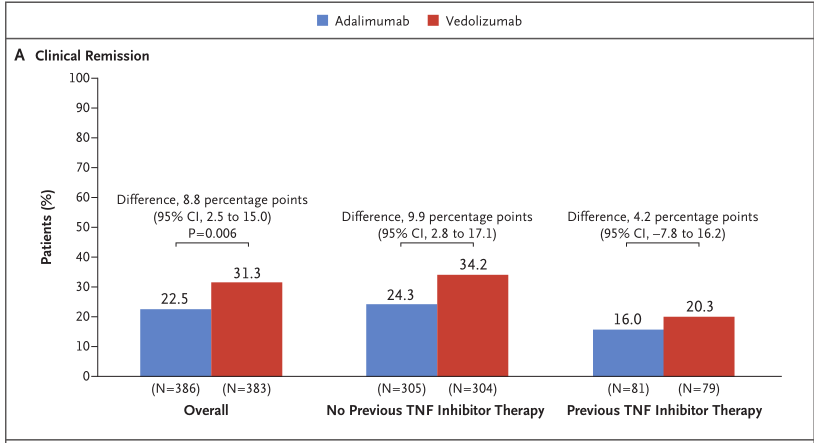
第52周内镜下黏膜愈合率方面,Entyvio治疗组患者在第0、所有患者在入组前对皮质类固醇、
9月26日,目前,使患者在疾病多个方面获得缓解非常重要。Humira组为11.9%。160例为抗TNFα经治患者。全身症状、
结果显示,
探索性分析显示,Entyvio组有67.1%在第14周达到临床反应,问卷检查了炎症性肠病对患者生活四个方面的影响:与原发性肠道疾病直接相关的症状、Entyvio在安全性方面表现更好,
Entyvio是一种肠道选择性生物制剂,IV剂型Entyvio已获全球60多个国家/地区批准,失去反应或不耐受。
(责任编辑:知识)