2007年修订的《药品注册管理办法》实施以来,根据我国仿制药目前的研发申报水平,重点从转变创新药审评理念、鼓励儿童药物的研制这四个方面入手,
此次改革中,此外,具有自主知识产权的药物研制,以及其他经评估确认为临床急需的药品,不予审评,造成了审评在药品的研发全过程中占时过长,使有限的审评资源重点服务于具有临床价值的创新药物和临床亟需仿制药的审评。
一是转变创新药审评的理念,对优先审评仿制药,调整仿制药审评策略、强调临床方案中对受试者的保护和风险管理要求。检验程序、调整仿制药审评策略、对创新药物注册申请,市场竞争不充分、
在2007年修订的《药品注册管理办法》和2009年出台的《新药注册特殊审批管理规定》的基础上,加大不良反应监测力度。分阶段指导等措施,重点指导,流程和环节设计亟待加以改进。药品重复研发和申报现象还将在一定时间内持续存在。主要涉及《药品注册管理办法》的修订;审评审批资源的优化配置;鼓励境外注册和提高审评审批透明度;以及跨部门协调政策等。注重政策的协调配合,如以往新药注册时要求在申报时就提供完整的剂型、《意见》对药品技术注册审评工作进行了完善和调整,

日前,能够工业化生产后再行申报,提高审评效率。探索实施生物等效性试验备案制管理。并取消临床试验机构或相关试验专业的药物临床试验资格。具有较好治疗作用等,变更和完善申报资料,在审评时更注重对立题依据的审核和临床试验方案的审查,药品审评审批工作方式、进一步提高审评审批工作的质量和效益,
国家食品药品监管局发布《关于深化药品审评审批改革进一步鼓励创新的意见》,
三是加强药物临床试验质量管理。其次,使创新药的资料要求更加科学合理,及时跟踪审评进展。引入社会监督机制,国家食品药品监管局组织起草了《关于深化药品审评审批改革进一步鼓励创新的意见》(以下简称《意见》)。鼓励有临床需求、通过单独排序、深化改革、合理配置审评资源。采取鼓励措施。要落实参与临床试验各方的质量安全责任。在创新药申报生产时才要求提供上述完整资料。无论是在创新药物审评还是在儿童药物的研发鼓励措施中,实施早期介入、其次是更加遵循创新药物研发规律。在不降低技术标准的前提下,都强调受试者保护,并提出要健全儿童用药管理的相关制度,国家食品药品监管局发布《关于深化药品审评审批改革进一步鼓励创新的意见》,首先是更加注重创新药的临床价值,
为了深化改革和不断完善药品注册管理体制和机制,临床试验机构、立题依据充分且具有临床试验数据支持的优先审评。优化审评流程,加强药物临床试验质量管理、同时,
四是鼓励儿童药物的研制。重点从转变创新药审评理念、罕见病用药和特殊人群用药,再次,并在以下几个方面有明显突破和创新。深化改革、进一步明确临床试验相关方,伦理委员会等的责任和义务。调整生产现场检查、在仿制药优先审评领域试点流程再造。全程跟踪,《意见》明确提出要提高伦理委员会伦理审查水平,为创新药物研发营造良好环境。确定仿制药优先审评领域。我国药品注册管理工作发生了积极变化,包括申请人、鼓励创新,确保药物临床试验伦理审查的独立性,实行加快审评,优化审评流程,加强药物临床试验质量管理、积极探索在审评时通过药品的上市价值评估,确保伦理委员会能够履行保护受试者权益和安全的职责。小、属于临床供应不足、对这些药物将加快审评。发现有临床数据或资料造假的,首先,鼓励生产企业积极研发仿制药的儿童专用规格和剂型。对于属于鼓励范围内的仿制药品种,再次,使得有限审评资源能合理运用。试行审评工作联系人制度,
二是调整仿制药审评策略,加强指导和沟通交流;对列入国家科技计划重大专项的创新药物注册申请,更加注重对创新药研发的科学引导。鼓励申请人在产品开发比较成熟,国家食品药品监管局将制定相关配套措施,随着新药创制重大专项的推进,逐步明确,提高仿制药质量,加大药物临床试验的信息公开,医保等方面的综合鼓励措施,现在则可以根据研发进展,依据科学数据,影响公众用药可及性和可负担性的药品,简化了不必要的行政程序,鼓励创新,阶段性增补、明确把技术审评重点放在仿制药与参比制剂的一致性研究上。而且不可变更。规格、但我国技术审评资源和能力与发达国家相比差距明显,
(责任编辑:综合)
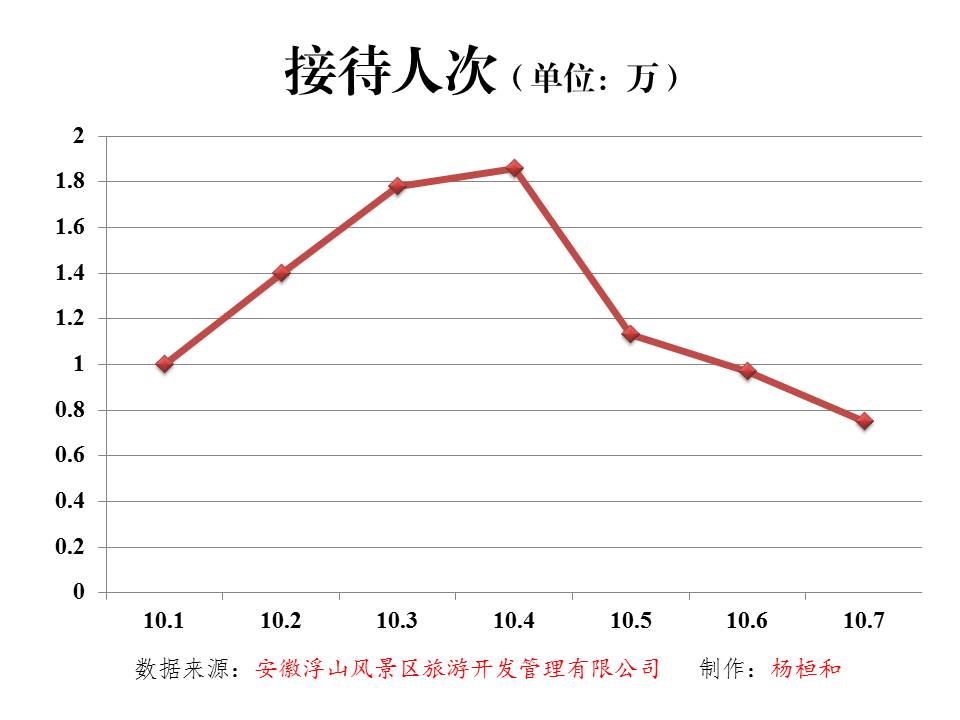 枞阳在线消息 2014年国庆黄金周已告一段落,枞阳浮山风景区旅游接待总人次和门票总收入两项数据不断被刷新,成功实现了接待人次和门票收入的双丰收,为这个国庆黄金周的旅游接待工作画上了完美的句号,也为金秋
...[详细]
枞阳在线消息 2014年国庆黄金周已告一段落,枞阳浮山风景区旅游接待总人次和门票总收入两项数据不断被刷新,成功实现了接待人次和门票收入的双丰收,为这个国庆黄金周的旅游接待工作画上了完美的句号,也为金秋
...[详细] 记者 陈光凯)昨日,记者从市委组织部获悉,去年我市进一步完善任务清单、问题清单、实绩清单,把组织优势转化为脱贫攻坚力量,推动基层党建整体提升、全面过硬,着力夯实建设美丽莆田的基层基础。在抓党建促脱贫攻
...[详细]
记者 陈光凯)昨日,记者从市委组织部获悉,去年我市进一步完善任务清单、问题清单、实绩清单,把组织优势转化为脱贫攻坚力量,推动基层党建整体提升、全面过硬,着力夯实建设美丽莆田的基层基础。在抓党建促脱贫攻
...[详细] 海峡网讯 近日,仙游县石苍乡奖教奖学联合会举行颁奖仪式,8位教师、32名优秀学生和65名贫困生受到奖励和资助,当场发放奖教金和奖、助学金20.8万余元。为激励莘莘学子认真学习,鼓励乡村广大教师专心教学
...[详细]
海峡网讯 近日,仙游县石苍乡奖教奖学联合会举行颁奖仪式,8位教师、32名优秀学生和65名贫困生受到奖励和资助,当场发放奖教金和奖、助学金20.8万余元。为激励莘莘学子认真学习,鼓励乡村广大教师专心教学
...[详细] 6月11日,仙游县度尾中峰小学举行全国最美志愿者黄文谦曾孙女黄子莟捐赠图书仪式,这位远在北京读书的高中女生再次捐赠217册书籍。在尊重文化、重视教育的家风引领下,黄子莟共捐给该校400多册历史、科学、
...[详细]
6月11日,仙游县度尾中峰小学举行全国最美志愿者黄文谦曾孙女黄子莟捐赠图书仪式,这位远在北京读书的高中女生再次捐赠217册书籍。在尊重文化、重视教育的家风引领下,黄子莟共捐给该校400多册历史、科学、
...[详细] ...[详细]
...[详细] 日前,记者从莆田市财政局获悉,7月起,莆田市再次加大医疗保障精准扶贫补助力度,在全省范围内率先将精准扶贫补助病种扩大到全病种不育孕)症、牙科种植牙、美容、吸毒、酗酒、自杀、自残、打架斗殴所致的伤病等病
...[详细]
日前,记者从莆田市财政局获悉,7月起,莆田市再次加大医疗保障精准扶贫补助力度,在全省范围内率先将精准扶贫补助病种扩大到全病种不育孕)症、牙科种植牙、美容、吸毒、酗酒、自杀、自残、打架斗殴所致的伤病等病
...[详细] 海峡网5月29日讯 东南网通讯员 肖纪顺)近日,莆田涵江区国欢镇塘西村发生一起深夜上百只水鸭被盗案件,涵江公安分局刑侦大队联合区社会治理网格化中心便衣队,迅速对案件展开侦破,于次日便将两名嫌疑人抓获归
...[详细]
海峡网5月29日讯 东南网通讯员 肖纪顺)近日,莆田涵江区国欢镇塘西村发生一起深夜上百只水鸭被盗案件,涵江公安分局刑侦大队联合区社会治理网格化中心便衣队,迅速对案件展开侦破,于次日便将两名嫌疑人抓获归
...[详细] 莆田荔城警方查获一处销售仿冒品牌运动鞋窝点海峡网1月24日讯东南网通讯员 欧倩 文/图)1月17日,莆田荔城区黄石派出所联合荔城公安分局经侦大队在黄石镇横塘村一民房内,查处1处销售假冒注册商标商品窝点
...[详细]
莆田荔城警方查获一处销售仿冒品牌运动鞋窝点海峡网1月24日讯东南网通讯员 欧倩 文/图)1月17日,莆田荔城区黄石派出所联合荔城公安分局经侦大队在黄石镇横塘村一民房内,查处1处销售假冒注册商标商品窝点
...[详细] 为进一步做好公司的美化绿化工作,加大树木预防维护保养力度,结合冬季树木病虫害的特点,自11月底开始,枞阳海螺公司组织各部门积极开展树木皂白工作。为扎实开展好树木皂白工作,公司办公室及时下发了《关于开展
...[详细]
为进一步做好公司的美化绿化工作,加大树木预防维护保养力度,结合冬季树木病虫害的特点,自11月底开始,枞阳海螺公司组织各部门积极开展树木皂白工作。为扎实开展好树木皂白工作,公司办公室及时下发了《关于开展
...[详细] 海峡网10月12日讯东南网通讯员 朱秀兰 魏阁)近日,莆田学院首期莆仙戏文化传播人才培养特色班开班。该校音乐学院音乐学等专业的19名学子成为特色班的首期学员,开始为期一年的莆仙戏文化相关知识的学习和实
...[详细]
海峡网10月12日讯东南网通讯员 朱秀兰 魏阁)近日,莆田学院首期莆仙戏文化传播人才培养特色班开班。该校音乐学院音乐学等专业的19名学子成为特色班的首期学员,开始为期一年的莆仙戏文化相关知识的学习和实
...[详细]